
微信扫码
◆
- 0538-8161828

订阅号


微博


一、种植体表面处理的临床意义:
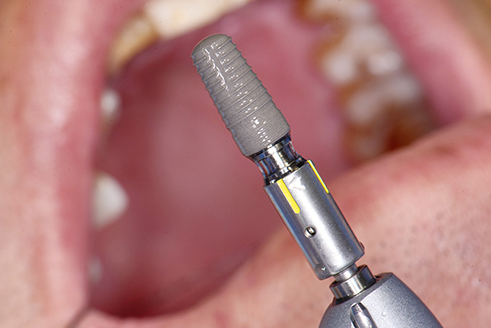
骨结合(Osseointegration)是口腔种植治疗的基石(图1)。
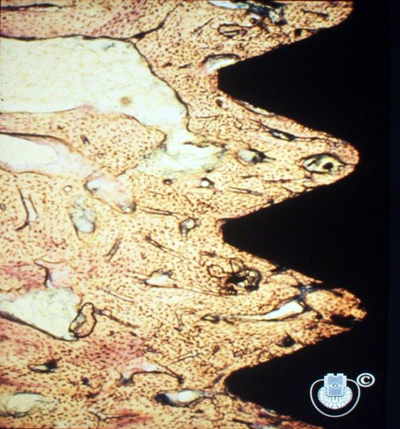
图1:1981年P.I Brånemark教授团队发布了世界第一张“骨结合”病理组织磨片
如何提高种植体与骨组织的结合率和结合速度一直都是口腔种植研究的热点。牙种植体的表面特性可影响植入后的生物学反应,决定组织细胞在其表面的粘附、增殖、分化及矿化,直接影响界面的骨愈合速度、骨结合率和骨结合强度,对种植体行使功能十分重要。因此,各种植体公司长期以来都努力采用不同的种植体表面处理工艺改变种植体表面特性来促进骨结合,提高种植体的成功率。总体而言,表面处理技术的进步也是一个不断发展与革新的历程,从机械抛光开始,历经了钛浆喷涂、羟基磷灰石涂层、可吸收研磨介质喷砂、电化学氧化、大颗粒喷砂酸蚀,生物学表面处理等多种不同的表面处理技术,有些表面处理技术目前已被临床所摒弃。
二、亲水种植体表面的原理与特点:
粗糙的种植体表面能够提高成骨细胞的迁移和增殖(图2),有利于形成骨结合 (Nasatzky等. 2003; Osathanon 等. 2011)。表面微孔介于1 - 100微米之间被认为是比较理想的表面粗糙度,有利于成骨细胞附着,形成良好的种植体骨结合。
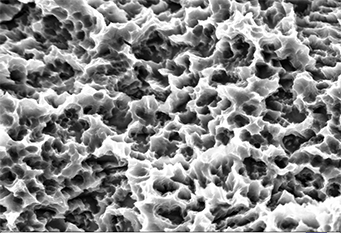
图2 2000倍扫描电镜下康盛亲水种植体表面形态
目前大多数种植体的表面处理都采用了喷砂或喷砂加酸蚀工艺(例如:大颗粒喷砂酸蚀处理SLA:Sand-blasted, Large grit, Acid-etched),通过减法处理工艺形成凹凸不平的种植体表面来增加表面积,种植体的表面也经常会采用酸处理,酸洗也能形成种植体表面的蚀刻效果,还能去除喷砂处理遗留在种植体表面的残余物(图3)。

图3 5000倍扫描电镜下酸处理钛表面的形态
大部分种植体的表面为疏水性,表现为水在其表面会形成水滴;而亲水性种植体表面对水有较大的亲和能力,可以吸引水分子,或易溶解于水;表现为水滴在其表面会很快被吸收(图4)。
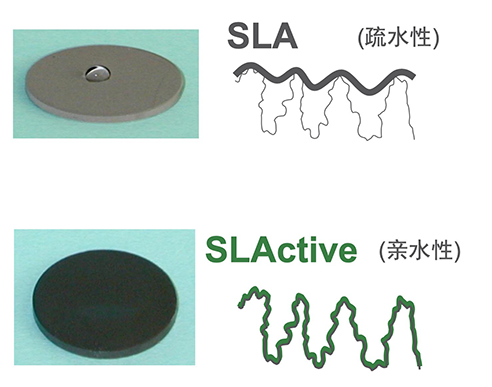
图4 疏水与亲水表面的对比(Straumanan公司资料)
2007年,Straumanan士卓曼公司首先推出喷砂酸蚀活化处理技术(SLActive);它通过刚玉颗粒(尺寸为250-550微米)喷砂钛柱,然后在沸腾的盐酸和硫酸溶液中进行酸蚀,之后通过硝酸来清洁,后续的制作过程始终处于氮气环境中,不接触空气,并用pH=5的生理盐水冲洗并储存。Schwarz研究认为,这种特殊的制造过程形成了羟基化/水合表面,能够通过减少对大气中潜在污染物(如碳氢化合物和碳酸盐)的吸附以保持高表面能。
有研究指出,经过亲水处理后的种植体表面可引发以下生物学过程:
(1)增加蛋白质的吸附
(2)增加成骨细胞的迁移
(3)增加成骨细胞的附着
(4)促进成骨细胞的扩散
(5)增加成骨细胞的增殖,促进成骨细胞分化。
因此亲水种植体表面在愈合早期的凝血块稳定性会增强,有利于早期的血管化及早期的钙化,进而早期的骨形成也会更加优良。
三、亲水表面种植体的临床优势:
Buser等2004年在动物实验中发现,亲水表面种植体的BIC更加优秀,骨密度较SLA表面增加,在早期即可获得更多的骨与种植体的接触面积,加速骨愈合的速度,提高继发稳定性的形成与实现,整体缩短临床愈合时间,种植体的愈合时间可以缩短到3-4周。Lang等2011年在人体试验中发现,2-4周之后,亲水表面的骨结合程度更高(图5)。
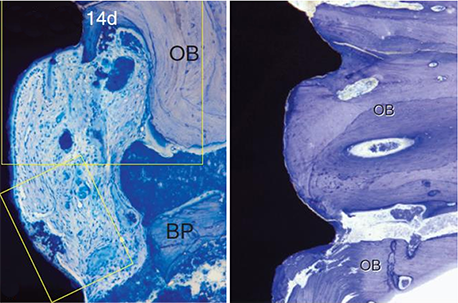
图5 亲水表面(左)在术后14天可发现薄薄一层新形成的骨覆盖整个种植体表面,在临时的软基质中存在骨屑和微小的编织骨小梁;而非亲水表面(右)则没有
亲水表面种植体对于炎症的调节和骨质条件不良的临床情况,有较为有利的研究结果。其中,关于不同种植体表面化学特性影响巨噬细胞释放抗炎细胞因子的体外研究表明,亲水表面种植体降低了人类巨噬细胞促炎因子的表达。通过调整促炎因子的表达这种重要的生物机制来促进和改善愈合。在糖尿病猪骨愈合过程中, 亲水表面种植体能够改善BIC和BD。另外,有实验研究发现Ⅰ型糖尿病大鼠骨愈合过程中,Ti表面特性对巨噬细胞表型分化影响的初步研究表明:亲水表面种植体能够调节由于糖尿病导致的过度炎性反应,并改善骨结合。
综上所述,在糖尿病、吸烟、骨质条件不佳等临床条件下推荐使用具有亲水表面的种植体系统,因为它能改善骨结合,提高治疗成功率。截至到目前(2020年8月),中国只有3个种植体系统获得了国家药监局亲水包装种植体的产品注册,分别是瑞士Straumanan 士卓曼SLActive、瑞士Thommen拓美以及中国康盛CANSUN亲水种植系统。康盛CANSUN亲水种植体于2016年通过了国家药监局亲水表面种植体的产品注册,填补了国产亲水包装种植体的空白;本篇临床评价的所有案例均使用康盛CANSUN亲水种植体(图6)。
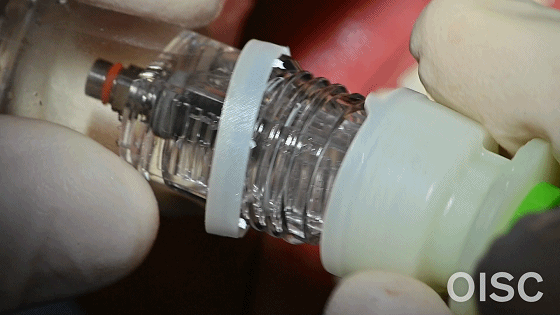
康盛CANSUN亲水种植体对血液有非常快速的吸引能力

图6 康盛CANSUN亲水表面与非亲水表面在测试中有非常显著的差异
四、康盛CANSUN亲水种植体1年期临床应用情况:
4.1 评价患者概况:
自2019年9月-2020年8月,共计完成9位患者的种植治疗,其中男性6人、女性3人,患者平均年龄53岁(图7);均为北京市级口腔种植继续教育课程的示教患者;手术及修复均由口腔种植读书会(OISC )专家组完成,所有案例均使用高清视频、照片完整记录手术、修复、义齿加工全过程,与患者术前、术后影像学资料统一存档管理。
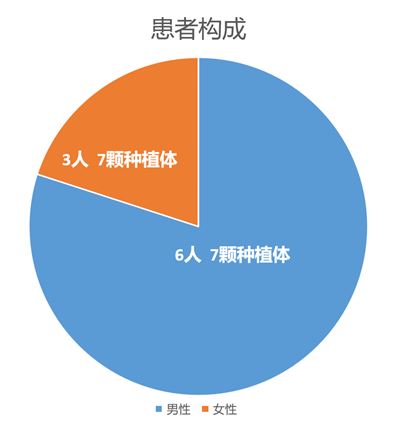
图7 评价患者的构成
9位患者共计手术植入14颗康盛CANSUN亲水种植体,截至到目前(2020年8月)无失败种植体;其中11颗已完成修复,修复完成后观察时间为5-9个月;患者的种植位点分布见图8 、图9 ;
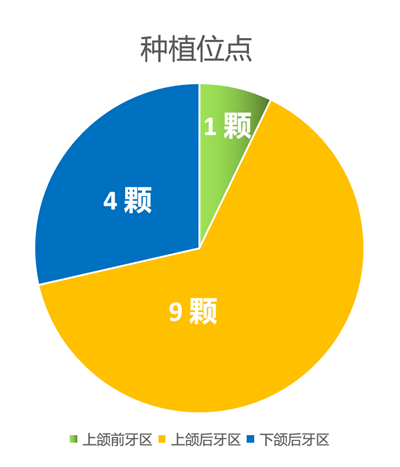
图8 种植位点的分布区域
图9 所有种植位点的口内照
实施骨增量手术患者3人-4颗种植体,分别为前牙GBR、后牙上颌窦提升术(图10 )。
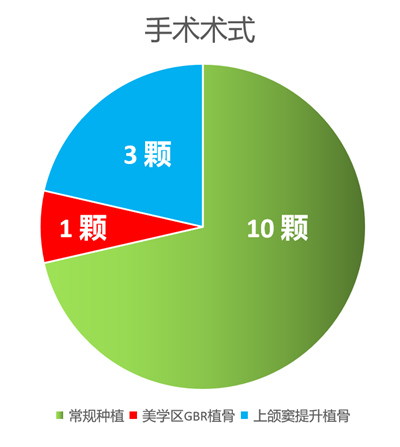
图10 采用的术式分类
患者中有重度吸烟习惯者(>10支/天)4人、服用双膦酸药物史者 1人(已停药);所有患者术前体检均满足口腔种植治疗要求(图11 )
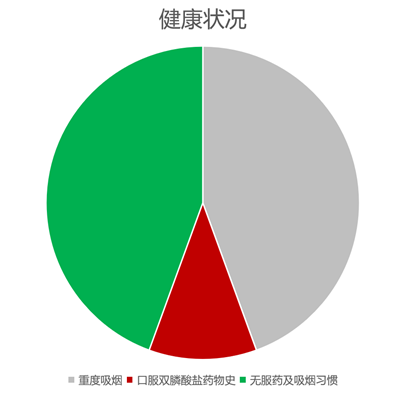
图11 患者健康状况
4.2 典型案例1-上颌后牙区上颌窦提升植骨
4.2.1 基本情况:患者为68岁女性,左侧上颌固定桥基牙折断考虑种植修复(图12),伴有全身骨质疏松,近3年有口服双膦酸盐药物史。
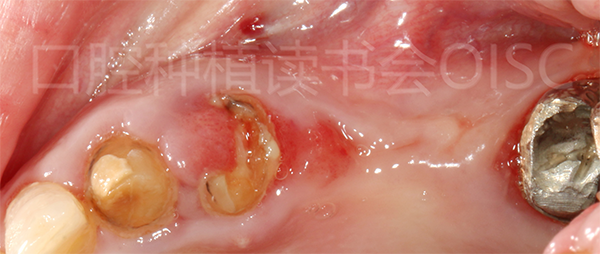
图12 25、26缺失、24折裂无法保留、27松动2度
4.2.2 治疗计划:
(1)停用双膦酸盐药物2周后拔除24,同期行CGF位点保存。
(2)23全冠修复后,择期行24、25、26种植修复。
(3)27暂时保留维持咬合关系,择期拔除。
4.2.3拔除24劈裂牙:
微创拔除24,轻微搔刮牙槽窝后,填入CGF,缝合固定(图13)。
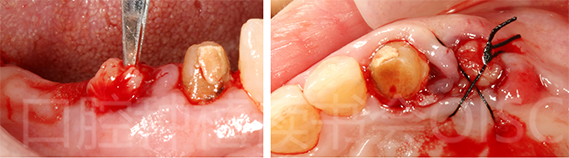
图13 使用CGF预防口服双膦酸盐药物可能导致的骨坏死
24拔除后,我们进行了连续观察,拔牙创愈合良好(图14)。
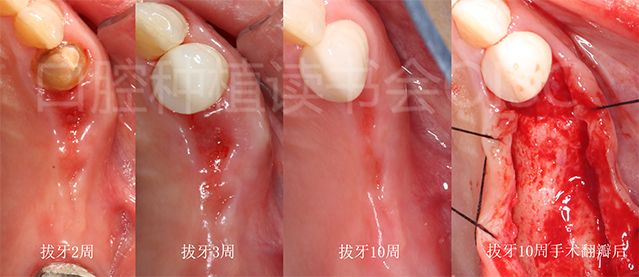
图14 24拔除后,连续观察至10周,手术翻瓣后发现位点骨愈合良好
4.2.4 种植术前影像学检查:
术前CBCT检查发现25、26区域骨高度不足,需行上颌窦内提升+同期种植体植入术(图15)。
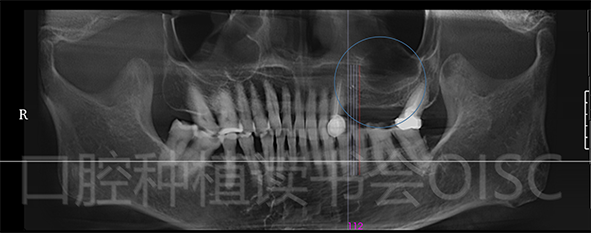
图15 25、26种植区域骨高度不足,骨密度较差
4.2.5 种植手术过程:
24、25、26术区做牙槽嵴顶正中切口,翻全厚瓣,暴露种植区域后,24常规预备种植窝洞;25、26备洞至距离上颌窦底骨壁1mm处,使用SCA上颌窦内提升工具盒提升窦底黏膜后,使用CGF与Cerasorb ®M德国科卢森骨粉(主要成分为纯相 β- 磷酸三钙)行上颌窦植骨(图16)。
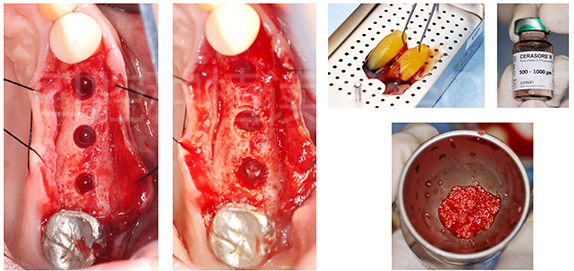
图16 25、26行上颌窦底提升植骨
完成上颌窦提升植骨后,24、25 、26 分别植入康盛CANSUN微锥亲水种植体(图17),型号分别为4.3*11mm(24)、4.3*9mm (25)、5.0*9mm(26),植入扭矩 > 35N.cm,初期稳定性良好。
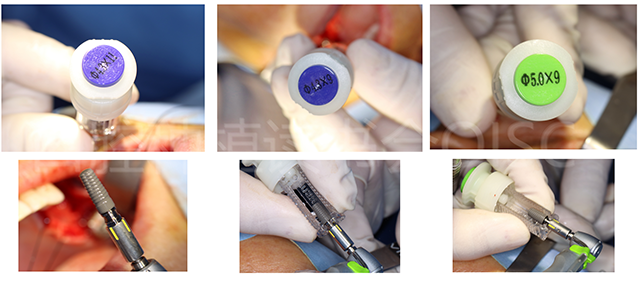
图17 24、25、26分别植入的种植体型号
植入后检查 24、25、26种植体轴向良好,旋入愈合基台,牙龈成型后间断缝合关闭创口(如图18 所示)。
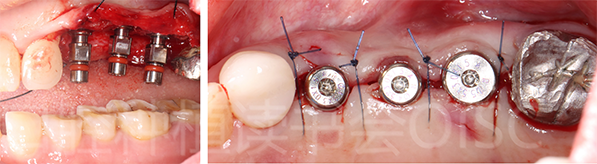
图18 24、25、26轴向良好
术后即刻CBCT显示上颌窦提升植骨效果良好(图19 )。
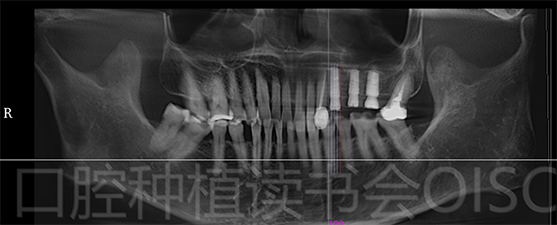
图19 术后即刻CBCT片
4.2.6 修复过程:
种植术后5个月X片及口内检查显示良好的软硬组织愈合;上颌窦提升植骨区域成骨良好(图20),愈合基台叩音清。
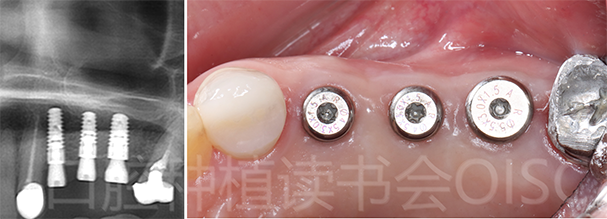
图20 24、25、26种植位点愈合良好
所有种植位点均显示出极佳的软、硬组织整合效果(图21)。
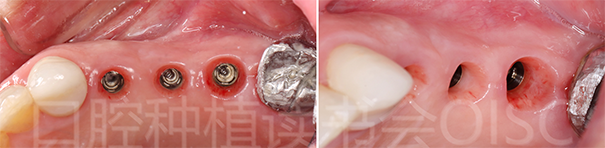
图21 24、25、26极佳的软、硬组织整合
种植取模前记录咬合关系,旋下愈合基台,安装开窗式印模柱后,使用扁钢丝+快速成型塑料对印模柱进行刚性连接,个别托盘+DMG Silagum加成型硅橡胶行种植取模(图22)。
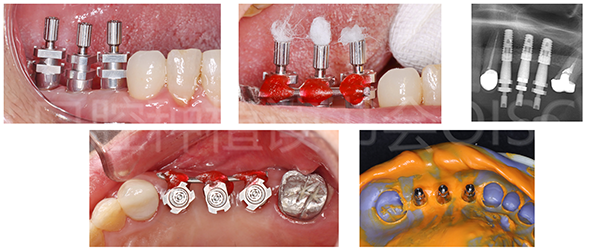
图22 24、25、26种植取模过程
哈尔滨芽美美牙工作室使用康盛CANSUN原厂CAD/CAM通用基台及爱尔创“魅影”氧化锆制作了24、25、26一体式螺丝固位全锆联冠(图23)。
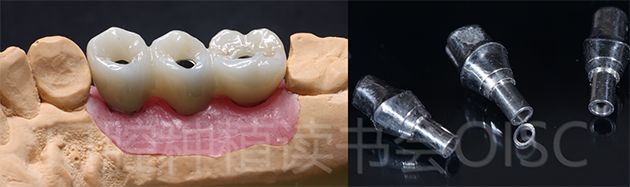
图23 完成的最终修复体
拔除27松动牙后,戴入24、25、26一体式种植联冠(图24)。
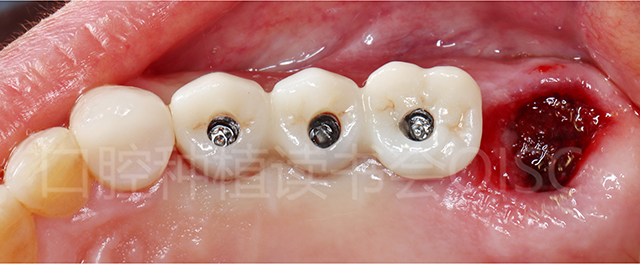
图24 戴入最终修复体
X片显示基台与种植体就位精确,24、25、26种植修复体以30N.cm力矩旋紧(图25)。

图25 X片确认基台精确就位后旋紧螺丝
24、25、26调合后,四氟乙烯胶带+3M光固化树脂封闭螺丝孔道,抛光,完成修复(图26 )。
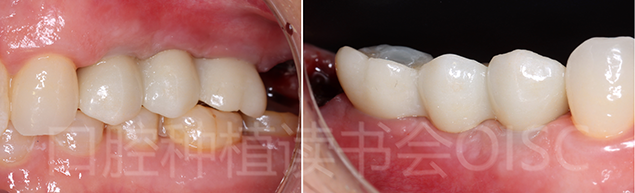
图26 完成最终修复后
4.3 典型案例2-上颌前牙区GBR植骨+同期种植
4.3.1 基本情况:患者为70岁男性,有重度吸烟习惯,左侧上颌前牙缺失后考虑种植修复(图27-左)。21位点曾行树脂粘接冠修复,口内检查及术前CBCT均提示21存在水平向及垂直向重度骨缺损(图27-右)。
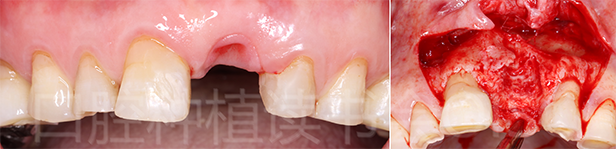
图27 21位点重度骨缺损
4.3.2 种植手术过程:
21种植位点行牙槽嵴水平切口,11远中、22远中附加垂直切口,翻全厚瓣至梨状孔下缘,发现21位点存在巨大的坑凹状骨缺损,并有大量炎性肉芽组织,去净软组织后;在前鼻棘处收集自体骨屑,偏腭侧预备21 种植窝洞(图28)。
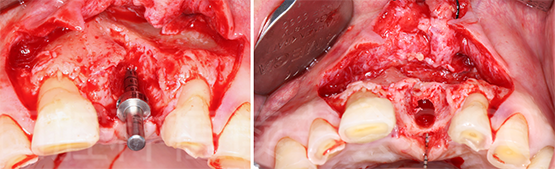
图28 21位点水平向及垂直向骨缺损
21位点植入康盛CANSUN柱形亲水种植体,型号为3.8*13mm(图29),植入扭矩为25N.cm。
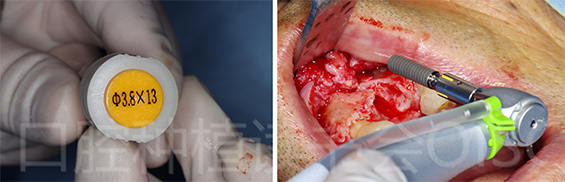
图29 21位点使用柱形亲水种植体
按照理想三维位置植入种植体后,发现唇侧种植体大面积暴露(图30)。
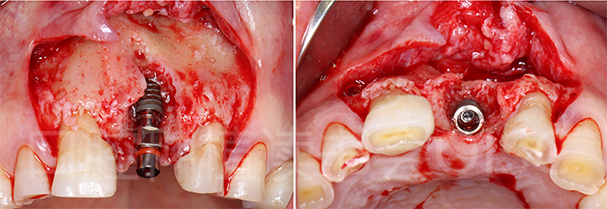
图30 21位点种植体就位后,有大面积种植体暴露
将自体骨屑与DBBM骨粉混合行GBR植骨术,使用膜钉及愈合基台固定胶原膜(图31)。

图31 21 行GBR植骨术
黏骨膜瓣充分减张后,严密缝合关闭创口(图32)。
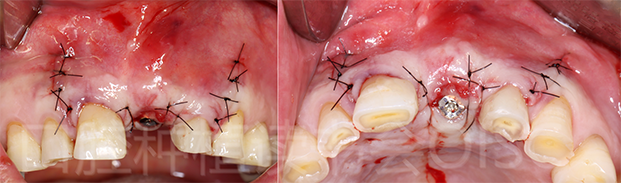
图32 21术后即刻
术后即刻CBCT显示:21位点骨增量效果显著(图33)。
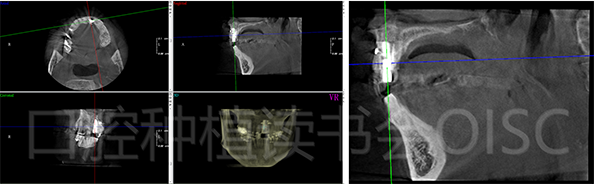
图33 21位点术后即刻CBCT
4.3.3修复过程:
21术后7个月,种植体软、硬组织愈合良好,唇侧牙弓轮廓形态良好(图34)。
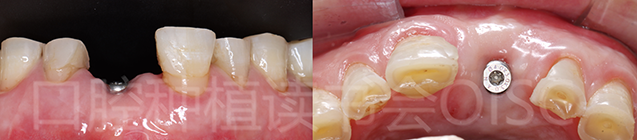
图34 骨增量后,21获得了非常好的牙弓轮廓
术后7个月CBCT显示21骨增量效果显著,种植体唇侧可见3-4mm厚度新生骨(图35 )。
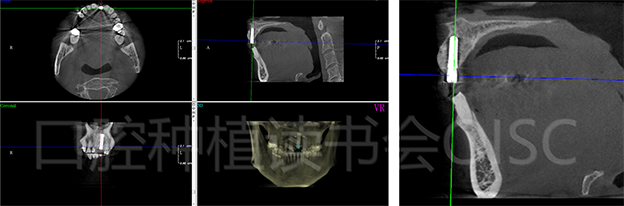
图35 21位点骨再生效果显著
由于患者时间的限制,拒绝了专家组提出的21位点种植临时冠软组织塑形及11、22瓷贴面修复的建议,要求直接修复,21安装开窗式印模柱制取种植印模(图36)。
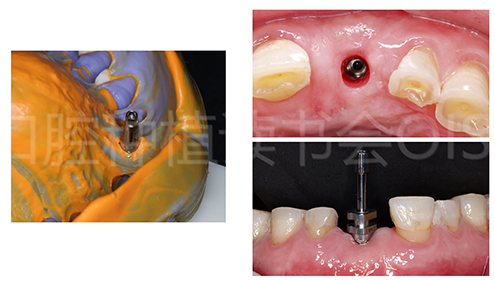
图36 21 种植取模过程
哈尔滨芽美美牙工作室参考邻牙形态,使用康盛原厂CAD/CAM通用基台及爱尔创“魅影”氧化锆制作螺丝固位全瓷冠(图37)。
图37 21戴入最终修复体
调合,抛光后, X片显示基台与种植体就位精确,21种植冠以20N.cm力矩旋紧(图38 )。
图38 X片确认基台就位后加力旋紧21种植冠
四、康盛亲水种植体临床应用评价:
通过对1年时间内完成的9位患者,共计14颗种植体的手术及修复情况进行回顾;口腔种植读书会(OISC)专家组针对康盛CANSUN亲水种植体的临床应用达成以下共识:
(1)所有的亲水种植体均未发生术后感染及早期失败,患者术后反映良好。
(2)非植骨位点的亲水种植体,术后8周均开始进行负重,已完成的修复案例均采用该负重方案,在后续的观察中未发现异常。
(3)无论是在骨增量位点或是骨质条件较好的位点,亲水种植体都表现出良好的软、硬组织整合能力。
(4)康盛原厂提供的CAD/CAM通用基台极大的方便了正式修复工作,所有已完成的案例均采用了原厂通用基台方案,基台与种植体的连接在观察期内未发生任何异常,后续将继续进行观察。
(5)极少数位点在使用微锥形种植体时,会出现最终成型钻预备时被邻牙干扰的情况;而使用柱形种植体未发现类似问题;后续将与厂家协作优化麻花钻的设计及推出新的临床建议。
综上,OISC专家组认为在完善的术前检查与治疗设计的前提下,通过规范的外科及修复操作,康盛CANSUN亲水种植体可以在不同口腔种植条件(包含骨条件不佳的情况)下获得满意的种植治疗效果,所有的案例将继续进行长期的观察与资料收集,OISC专家组将密切关注其长期的治疗效果并定期公布。
五、致谢与申明:
感谢康盛CANSUN公司为患者提供的种植体及配件支持;除此外康盛CANSUN亲水种植体与OISC专家组无其他任何经济利益。
OISC专家组均为经验丰富的口腔种植医生;所有患者在治疗前均进行了完善的检查与治疗设计。本篇临床评价是OISC专家组回顾1年期亲自治疗的患者情况所得出的结论;专家组并不能完全保证其他医生或医疗机构使用康盛CANSUN亲水种植体也能获得与本评价相同的治疗效果。专家组确信在种植体系统之外,医生的知识储备、完善的检查与方案设计、规范的操作技术都会极大的影响患者最终的种植治疗效果。
六、参考文献:
1. Kasemo B, Lausmaa J. Biomaterial and implant surfaces: On the role of cleanliness, contamination, and preparation procedures. J Biomed Mater Res 1988;22:145–158.
2. Kilpadi DV, Lemons JE, Liu J, Raikar GN, Weimer JJ, Vohra Y. Cleaning and heat-treatment effects on unalloyed titanium implant surfaces. Int J Oral Maxillofac Implants 2000;15:219–230.
3. Serro AP, Saramago B. Influence of sterilization on the mineralization of titanium implants induced by incubation in various biological model fluids. Biomaterials 2003;24:4749–4760.
4. Ellingsen JE. A study on the mechanism of protein adsorption to TiO2. Biomaterials 1991;12:593– 596.
5. Klinger A, Steinberg D, Kohavi D, Sela MN. Mechanism of adsorption of human albumin to titanium in vitro. J Biomed Mater Res 1997;36:387–392.
6. Steinberg D, Klinger A, Kohavi D, Sela MN. Adsorption of human salivary proteins to titanium powder. I. Adsorption of human salivary albumin. Biomaterials 1995;16:1339–1343.
7. Att W, Hori N, Takeuchi M, et al. Time-dependent degradation of titanium osteoconductivity: An implication of biological aging of implant materials. Biomaterials 2009;30:5352–5363.
8. Iwasa F, Hori N, Ueno T, Minamikawa H, Yamada M, Ogawa T. Enhancement of osteoblast adhesion to UV-photofunctionalized titanium via an electrostatic mechanism. Biomaterials 2010;31:2717–2727.
9. Schwarz F, Wieland M, Schwartz R, et al. Potential of chemically modified hydrophilic surface characteristics to support tissue integra- tion of titanium dental implants. J Biomed Mater Res B Appl Biomater. 2009;88:544–557.
10. Kopf B S , Ruch S , Berner S , et al. The role of nanostructures and hydrophilicity in osseointegration: In‐vitro protein‐adsorption and blood‐interaction studies[J]. Journal of Biomedical Materials Research Part A, 2015, 103(8):2661-2672.
11.Raghavendra S, Wood MC, Taylor TD. Int. J. Oral Maxillofac. Implants. 2005 May–Jun;20(3):425–31.
12.Kelly, M, Hotchkiss,et al. Dental implant surface chemistry and energy alter macrophage activationin vitro[J]. Clinical Oral Implants Research, 2016.
13.Lang NP, Salvi GE, Huynh-Ba G, Ivanovski S, Donos N, Bosshardt DD.: Early osseointegration to hydrophilic and hydrophobic implant surfaces in humans. Clin Oral Implants Res. 2011 Apr;22(4):349-56
-----------------------------------------------------------------------------------------------------------------
本文由OISC专家组提供, 在此感谢各位专家的分享